Oder auch Stauungshepatitis
Ich habe ja demnächst im November meinen Termin beim Amtsarzt in Plön. Es geht da um meine Rechtsherzinsuffizienz. Ich habe bisher von jedem Hausarzt den Tipp bekommen, nicht zu lange zu sitzen, genug zu schlafen, mich nicht zu überanstrengen, mich viel, aber gemütlich zu bewegen, dann könnte ich damit recht alt werden.
Meine Mutter hatte das auch und ist mit zig Medikamenten, die ihr eigentlich nicht gut bekommen sind, immerhin 91 geworden.
Zu hoch waren bei meiner letzten Untersuchung meine Gamma-GT-Werte, und zwar mehr als 3 x so hoch wie normal .. Zahlen findet man irgendwo hier im Blog, ich habe den genauen Wert vergessen und jetzt auch keine Lust, danach zu suchen.
In meiner Gewebeprobe, die ja eigentlich eine auf Schilddrüsenkrebs war, befanden sich Siderophagen, das heißt übersetzt Herzfehlerzellen, die die gleiche Ursache haben wie der hohe Gamma-GT-Wert, nämlich die Rechtsherzinsuffizienz.
Ich habe da jetzt einen sehr komplizierten Text gefunden. Den will ich hier mal konservieren, damit er erhalten bleibt. In erster Linie für mich, weil ich den recht interessant finde .. aber natürlich auch für andere Menschen, die vielleicht nach den gleichen Sachen suchen, weil sie die gleichen Krankheitssymptome haben wie ich.
Unten Link inklusive Text.
Kann sein, dass ich über das Thema später noch mehr poste .. vorausgesetzt, ich finde überhaupt was.
LG
Renate
Frank
Noack, Alexander Zipprich und Matthias Dollinger, Halle
Zirrhotische Kardiomyopathie
Funktionelle kardiovaskuläre
Veränderungen mit einer hyperdynamen Zirkulation bei erniedrigtem peripheren
Gefäßwiderstand und erhöhtem Herzzeitvolumen wurden bei Patienten mit
Leberzirrhose bereits vor über 50 Jahren beschrieben. Lange galt die Annahme,
dass das Herz hierbei lediglich auf die hämodynamischen Veränderungen als Folge
der Zirrhose reagieren würde, ohne selbst Schaden dabei zu nehmen. Erst in den
letzten Jahren löste die Entdeckung einer häufigen - unter Ruhebedingungen aber
meist maskierten - systolischen und diastolischen Dysfunktion mit reduzierter
kardialer Kontraktilität bei Patienten mit fortgeschrittenem chronischen
Leberversagen eine Debatte über eine putative hepato-kardiale Achse aus. Das
Syndrom, welches sich häufig erst unter kardiovaskulären Belastungssituationen
klinisch demaskiert, wurde als zirrhotische Kardiomyopathie definiert und
erlangt nun zunehmend klinisches und wissenschaftliches Interesse.Pathophysiologie
Bei Patienten mit Leberzirrhose führen eine zunehmende Verschlechterung der Leberfunktion sowie die Entwicklung einer portalen Hypertension zu einer hyperdynamen Zirkulation mit erniedrigten peripheren Gefäßwiderständen und erhöhtem Herzzeitvolumen. Dabei spielen verschiedene Pathomechanismen eine Rolle. Zum einen bedingt der erhöhte sinusoidale Gefäßwiderstand mit reaktiver Freisetzung vasoaktiver Mediatoren (NO, Cannabinoide, CO) eine Gefäßdilatation im Splanchnikusstromgebiet, und damit eine Verminderung des zentralen (oder „effektiven“) Blutvolumens (trotz gleichzeitiger Erhöhung des Gesamtvolumens). Als Folge werden Blutdruck-steigernde Systeme wie das Renin-Angiotensin-Aldosteron-System oder das sympathische Nervensystem über Volumen- und Barorezeptoren aktiviert, die wiederum die Niere zur Na- und Volumenretention stimulieren. Eine initial bestehende Vasodilatation im arteriellen Stromgebiet verstärkt die zentrale Hypovolämie. Ursächlich hierfür sind eine mit Fortschreiten der Zirrhose progrediente Abnahme der arteriellen Gefäßwanddicke, ein durch NO-Überproduktion und endotheliale Dysfunktion (Hyporeagibilität auf Adrenalin und Angiotensin-II) verminderter arterieller Gefäßtonus und funktionelle Veränderungen in den Elektrolytkanälen der Gefäßwände, welche zu einer veränderten arteriellen Compliance führen.Während die Entwicklung einer hyperdynamen Zirkulation unter Ruhebedingungen eine zunächst adäquate Reaktion auf die oben beschriebenen hämodynamischen Veränderungen darstellt, kann es im weiteren Verlauf zur Ausprägung einer verminderten myokardialen Kontraktilität mit diastolischer Relaxationsstörung und somit zum Krankheitsbild einer zirrhotischen Kardiomyopathie kommen. Ebenso scheint eine autonome Dysfunktion mit Beteiligung des sympathischen und parasympathischen Nervensystems und gestörten kardiovaskulären Reflexen eine Rolle in der Entwicklung einer zirrhotischen Kardiomyopathie zu spielen. In histologischen Untersuchungen zeigten sich eine diffuse ungleichmäßige Fibrose, eine Muskelhypertrophie sowie ein subendotheliales Ödem.
Definition
Definiert ist die zirrhotische Kardiomyopathie somit als eine chronische kardiale Dysfunktion bei Patienten mit Leberzirrhose, welche durch eine ungenügende myokardiale Kontraktilität bei Stress und/oder eine diastolische Funktionsstörung bei fehlender kardialer Vorerkrankung charakterisiert ist. Sie ist mittlerweile gut von der alkoholischen Kardiomyopathie (Einschränkung der Synthese kontraktiler Proteine und Bildung immunogener kardialer Protein-Acetaldehyd-Produkte) abzugrenzen und tritt unabhängig von der zugrundeliegenden Ätiologie der Leberzirrhose auf.Klinische Manifestationen
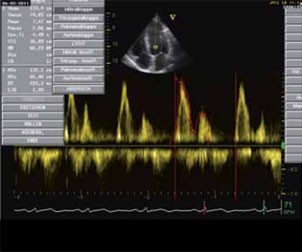
Abbildung 1: Echokardiographisch regelrechte E/A-Ratio (Verhältnis der passiven zu der aktiven linksventrikulären Füllung).
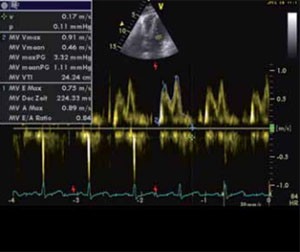
Abbildung 2: Inverse E/A-Ratio (<1) als Zeichen einer diastolischen Dysfunktion.
Shunts (TIPS) - akute Vorlasterhöhung durch „Verschiebung“ eines Teils des portalvenösen Blutes in den systemischen Kreislauf - zu einer Dekompensation der hyperdynamen Kreislauflage mit steigendem Herzminutenvolumen, erhöhten enddiastolischen Volumina und vermindertem peripheren Gefäßwiderstandes führen. Ebenso ist das post-interventionelle Auftreten einer akuten „high-output“-Herzinsuffizienz mit Erhöhung des pulmonal-arteriellen Druckes und des pulmonal-kapillären-Verschlussdruckes beschrieben. Weitere mit hämodynamisch-kardialem Stress vergesellschaftete Situationen, bei welchen die myokardiale Reserve eines zirrhotischen Herzens nicht mehr ausreichen kann, sind Aszitespunktionen, Infektionen (z.B. spontan bakterielle Peritonitis), Dehydratationen (z.B. bei Diarrhoe), Operationen inklusive Lebertransplantation oder ein hepatorenales Syndrom. In der Pathogenese des letzteren scheint eine im Rahmen einer zirrhotischen Kardiomyopathie wahrscheinlich bestehende renale Minderperfusion eine Rolle zu spielen.
Klinisch nachweisbar im Rahmen der Kardiomyopathie sind außerdem multiple elektrophysiologische Veränderungen (QT-Intervall-Veränderungen, elektro-mechanische Dyssynchronie, chronotrope Inkompetenz) sowie eine kardiale autonome Dysfunktion (verminderte Baroreflex-Sensitivität). Von diagnostischer Bedeutung ist ein Anstieg der kardialen Serummarker (BNP, pro-BNP, Troponin I), welcher sich bei einem Teil der Patienten findet.
Die Prävalenz der zirrhotischen Kardiomyopathie ist nicht bekannt, tendenziell scheint sie aber mit zunehmender Progredienz der Grunderkrankung fortzuschreiten. Da die systolische und diastolische Dysfunktion mit verminderter ventrikulärer Kontraktilität sowie die autonome Dysfunktion mit verminderter Baro-Reflex-Sensitivität und verringerter Herzfrequenzvariabilität die Fähigkeit des „zirrhotischen Herzens“, adäquat auf Stresssituationen zu reagieren, einschränken, wird auch die Gesamtprognose der Grunderkrankung davon betroffen.
Diagnostik
Diagnostische Kriterien
Systolische Dysfunktion- Unzureichender Anstieg des Herzminutenvolumens bei körperlicher Belastung, Volumenbelastung oder medikamentöser Stimulation
- Linksventrikuläre Ejektionsfraktion in Ruhe <55%
- E/A – Ratio <1.0 (alterskorrigiert)
- Verlängerte Dezelerationszeit (>200 ms)
- Verlängerte isovolumetrische Relaxationszeit (>80 ms)
Supportive Kriterien
- Elektrophysiologische Veränderungen
- Chronotrope Inkompetenz
- Elektromechanische Dissoziation/-Dyssynchronie
- Verlängerte QTc-Zeit
- Vergrößerter linker Vorhof
- Erhöhte myokardiale Masse
- Erhöhtes BNP und pro-BNP
- Erhöhtes Troponin I
Therapieoptionen
Eine spezifische pharmakologische Therapie der zirrhotischen Kardiomyopathie kann aktuell bei fehlender Evidenz nicht empfohlen werden. Daher ist die medikamentöse Therapie des insuffizienten Herzens an die Herzinsuffizienz-Leitlinien der Deutschen Gesellschaft für Kardiologie angelehnt und vom klinischen Gesamtkontext abhängig. Ein entsprechend vorsichtiges, engmaschiges, monitorgesteuertes Volumenmanagement ist bei hämodynamischen Stresssituationen mit Veränderungen von Vor- und Nachlast (wie z.B. Aszitespunktion, TIPS-Anlage, Infektionen, Dehydratation, Lebertransplantation, hepatorenales Syndrom) notwendig, um eine kardiovaskuläre Dekompensation frühzeitig zu erkennen und ggf. entsprechend intensivmedizinisch (z.B. unter Einsatz vasopressorischer Substanzen) zu behandeln.Einen kausalen Therapieansatz stellt bei fortgeschrittener Leberzirrhose die Lebertransplantation dar, wobei die hämodynamischen Veränderungen nach Transplantation und ihre Auswirkungen auf das Krankheitsbild der zirrhotischen Kardiomyopathie in der perioperativen und der postoperativen Phase getrennt betrachtet werden sollten. Perioperativ steht aufgrund der akut reduzierten Vorlast mit ggf. entsprechend notwendigem exzessivem Volumenmanagement das Risiko einer akuten kardialen Dekompensation im Vordergrund. Ebenso besteht in diesen Phasen die Gefahr eines Post-Reperfusionssyndroms mit der möglichen Folge einer kardiovaskulären Instabilität. In der Spätphase nach Transplantation ließ sich in den meisten Untersuchungen eine teilweise oder vollständige klinische Regredienz der mit einer hyperdynamen Zirkulation und zirrhotischer Kardiomyopathie vergesellschafteten hämodynamischen und kardialen Veränderungen nachweisen. So zeigten sich unter Ruhebedingungen ein Abfall des Herzminutenvolumens, der Herzfrequenz und des pulmonalarteriellen Druckes sowie ein Anstieg des systemischen Blutdruckes und des systemischen Gefäßwiderstandes. Ebenso waren eine Reduktion der myokardialen Masse und eine Verbesserung der systolischen und diastolischen Funktion nachweisbar. Die verlängerte QT-Zeit verringerte sich bei der Hälfte, die autonome Dysfunktion besserte sich bei zwei Dritteln der Patienten.
Zusammenfassung
Die zirrhotische Kardiomyopathie mit systolischer und diastolischer Funktionsstörung ist Teil eines Multiorgansyndroms bei Patienten mit fortgeschrittener Leberzirrhose und hyperdynamer Kreislaufdysfunktion, das pathophysiologische Veränderungen im Bereich der Nieren, der Lunge, des Gehirns, der Haut, des Herzens und der Muskeln miteinschließt. Während unter Ruhebedingungen meist keine (oder nur eine gering ausgeprägte) klinische Symptomatik besteht, können hämodynamische Stresssituationen (z.B. Aszitespunktion, TIPS-Anlage, Infektionen, Dehydratation, Lebertransplantation oder hepatorenales Syndrom) zu einer kardiovaskulären Dekompensation mit entsprechender Erhöhung der Morbidität und Mortalität des Patienten führen. Daher sollte im Rahmen entsprechender klinischer Konstellationen bei fortgeschrittener Leberzirrhose ein engmaschiges Monitoring erfolgen. Die Therapie ist an die Herzinsuffizienz-Leitlinien der Deutschen Gesellschaft für Kardiologie angelehnt und ist vom klinischen Gesamtkontext abhängig. Spezifische, medikamentöse Therapieoptionen können derzeit bei fehlender Evidenz nicht empfohlen werden. Eine Lebertransplantation verbessert meistens im Langzeitverlauf die kardiale Dysfunktion, kann jedoch perioperativ zur Dekompensation des „zirrhotischen Herzens“ führen. Die zirrhotische Kardiomyopathie ist von der alkoholischen Kardiomyopathie gut abzugrenzen und tritt unabhängig von der zugrundeliegenden Ätiologie der Leberzirrhose auf.Literatur beim Verfasser
Frank Noack, Dr. Alexander Zipprich und PD Dr. Matthias Dollinger PhD
Universitätsklinikum Halle (Saale)
Universitätsklinik und Poliklinik für Innere Medizin I
Ernst-Grube-Straße 40
06120 Halle
Email: matthias.dollinger@medizin.uni-halle.de
Keine Kommentare:
Kommentar veröffentlichen
Dein Kommentar wird nach Prüfung durch einen Moderator frei gegeben.